联系我们
仲邈检测技术(上海)有限公司
电话:400-869-7268
孔老师:18101860670
李老师:18117149592
网址:www.shzmiao.com
邮箱:sales@shzmiao.cn
地址:上海市诸光路1588弄虹桥世界中心B栋一楼763号
进口医疗器械注册/备案
一、监管部门
国家药品监督管理局主管全国医疗器械注册与备案管理工作,负责建立医疗器械注册与备案管理工作体系和制度,依法组织进口第二类、第三类医疗器械注册的审评审批工作,进口第一类医疗器械备案以及相关监督管理工作。
进口第一类医疗器械备案,备案人向国家药品监督管理局提交备案资料。
进口第二类、第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
二、进口医疗器械注册的法规依据:
进口医疗器械注册的法规依据主要有两个:
1、《医疗器械监督管理条例》;
2、《医疗器械注册管理办法》。在这个两个法规的基础上,国家出台了一系统行政法规、标准用于规范进、指导口医疗器械注册工作。
三、进口医疗器械备案/注册资料清单
1、进口一类医疗器械备案资料清单
1)、境外医疗器械注册申请表;
2)、医疗器械生产企业资格证明;
3)、申报者的营业执照副本和生产企业授予的代理注册的委托书;
4)、境外政府医疗器械主管部门批准或认可的该产品作为医疗器械进入该国(地区)市场证明文件;
5)、适用的产品标准;
6)、医疗器械说明书;
7、医疗器械检测机构出具的产品注册检测报告(适用于第二、三类医疗器械);
8)、医疗器械临床试验资料;
9)、生产企业出具的产品质量保证书;
10)、产企业在中国指定代理人的委托书、代理人的承诺书及营业执照或者机构登记证明;
11)、在中国指定售后服务机构的委托书、受委托机构的承诺书及资格证明文件;
12)、所提交材料真实性的自我保证声明。
2、进口二、三类医疗器械注册资料清单
1)、申请表
2)、证明性文件
a、原产国允许产品上市销售的证明文件。
b、生产企业资格证明文件。
c、代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
3)、医疗器械安全有效基本要求清单
4)、综述资料
5)、研究资料
6)、生产制造信息
7)、临床评价资料
8)、产品风险分析资料
9)、产品技术要求
10)、产品检验报告
11)、产品说明书和最小销售单元的标签样稿
12)、符合性声明
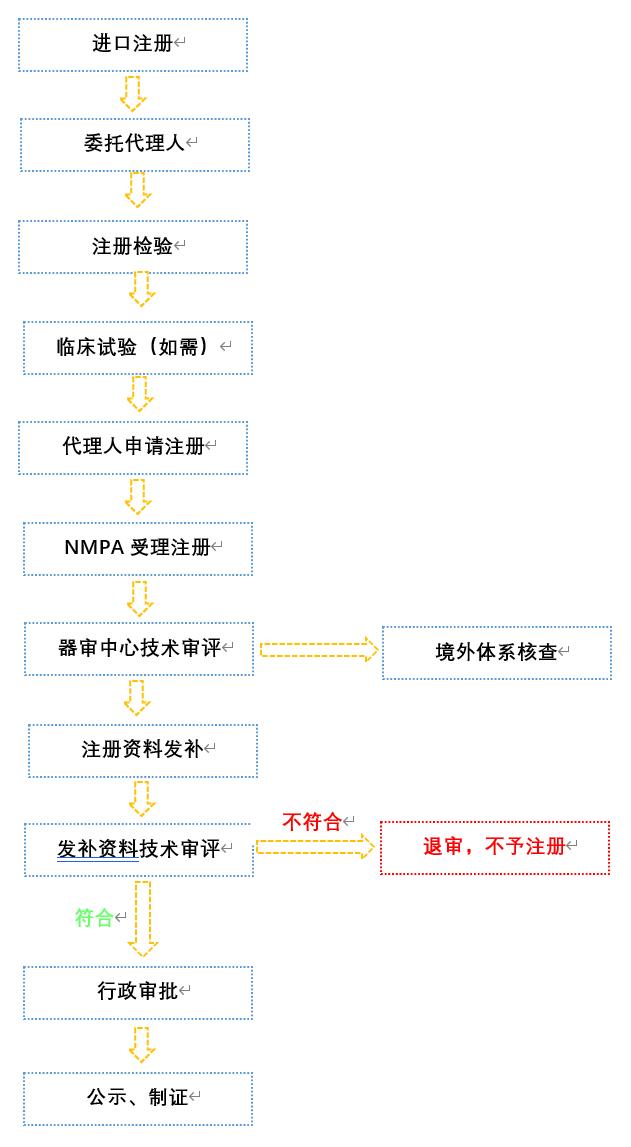
四、申请流程