联系我们
仲邈检测技术(上海)有限公司
电话:400-869-7268
孔老师:18101860670
李老师:18117149592
网址:www.shzmiao.com
邮箱:sales@shzmiao.cn
地址:上海市诸光路1588弄虹桥世界中心B栋一楼763号
澳大利亚TGA注册
一、 澳大利亚TGA
1. 澳大利亚医疗器械监管局

TGA(Therapeutic Goods Administration)是澳大利亚医疗器械的主管部门,它是澳大利亚的医疗用品(包括药物、医疗器械、基因科技和血液制品)的监督机构,具体负责医疗卫生用品的进口、出口、生产、供应和推广工作。
2. 相关法规
Therapeutic Goods Act 1989
Therapeutic Goods (Medical Devices) Regulations 2002
3. 风险等级分类

4. 注册依据
医疗器械和IVD产品都需要提供制造商证据才能提交TGA注册,目前可以被接受的制造商证据有:
①澳洲本土颁发的符合性评定证书AU CAB/ COC
②MDSAP证书|ISO 13485证书
③目前TGA认可的注册批准有:
• AU CAB certificate.
• TGA Conformity Assessment Certificate
• EC certificate
• Health Canada Licence
• Japan Pre market Certification/ Approval
• Singapore HSA certificate
• MRA Certificate
• US FDA 510(k) Determination
• US FDA De Novo Order
• US FDA Premarket Approval
5. 注册语言
英语
6. 澳大利亚Sponsor
-
澳洲医疗器械的持证人sponsor负责向TGA申请将其治疗性物品列入澳大利亚医疗用品登记处(ARTG) ;
-
在澳大利亚,医疗产品必须列入ARTG才能出售;
-
Sponsor必须是澳大利亚居民,或者是在澳大利亚注册成立并在澳大利亚开展业务的机构,且公司代表居住在澳大利亚。
为了支持TGA的上市后监测活动,一旦器械被列入ARTG,医疗器械的代理人就有持续的责任。这些法定责任包括:代理人必须向TGA报告
-
不良事件
-
海外监管行动
-
制造商进行调查的结果,如进一步的临床研究和不良事件的审查。
-
代理人还必须从制造商那里获得所要求的信息,并保持分销记录。
TGA收到的所有不良事件报告或投诉都被输入数据库,并由TGA内部的临床医生和科学家小组进行风险评估,以确定是否需要调查。在调查期间可能会征求专家意见。
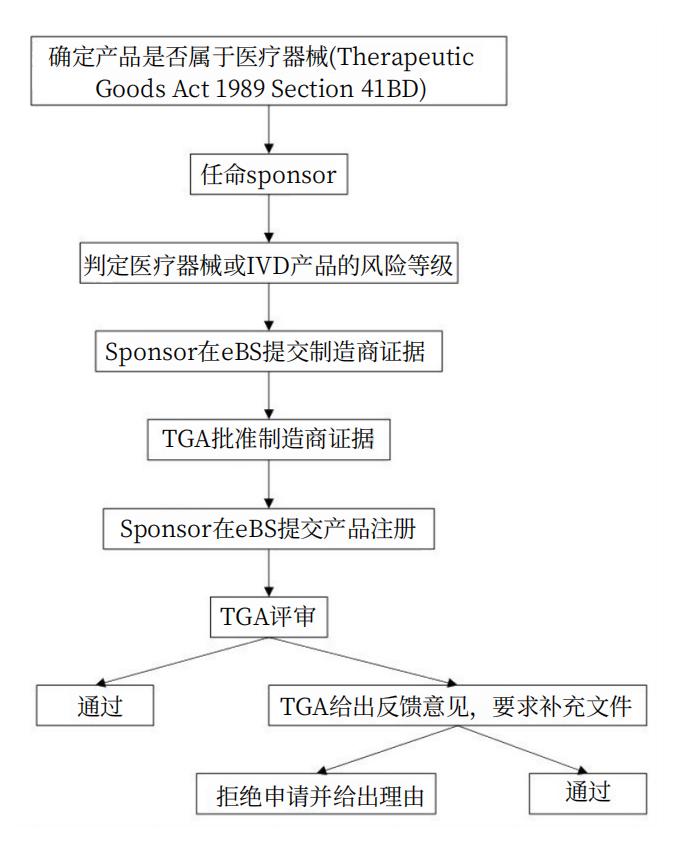
二、 注册流程|官费
1. 注册流程